-
جدول المحتويات
- نموذج يمثل عدد الذرات ونوعها
- النموذج الذري
- الجدول الدوري
- التركيب الإلكتروني
- التفاعلات الكيميائية
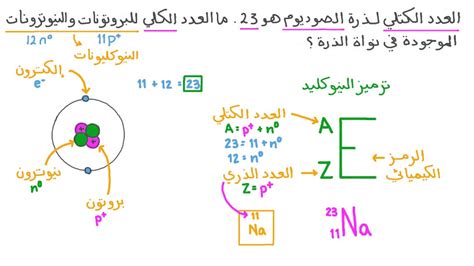
نموذج يمثل عدد الذرات ونوعها
عندما نتحدث عن الذرات وتركيبها، نجد أن هناك نموذجًا يمثل عدد الذرات ونوعها بشكل دقيق. هذا النموذج يعتبر أحد الأسس الأساسية في علم الكيمياء ويساعدنا في فهم كيفية تكوين المواد وتفاعلها.
النموذج الذري
يعتمد النموذج الذري على فكرة أن الذرة تتكون من نواة مركزية تحتوي على البروتونات والنيوترونات، محاطة بالإلكترونات التي تدور حول النواة. ويعتبر العدد الذري للعنصر هو عدد البروتونات في النواة، وهو ما يحدد نوع العنصر.
الجدول الدوري
من ناحية أخرى، يوجد الجدول الدوري للعناصر الذي ينظم العناصر حسب عددها الذري وخصائصها الكيميائية.
. يمكننا من خلال الجدول الدوري معرفة ترتيب العناصر وتوقع سلوكها في التفاعلات الكيميائية.
التركيب الإلكتروني
على سبيل المثال، يمكننا استخدام النموذج الذري لفهم التركيب الإلكتروني للذرات. حيث يتم توزيع الإلكترونات في المستويات الإلكترونية حسب القواعد المعروفة، مما يؤثر على خصائص العنصر وقدرته على التفاعل مع العناصر الأخرى.
التفاعلات الكيميائية
في النهاية كما، يمكننا استخدام النموذج الذري لفهم التفاعلات الكيميائية بشكل أفضل. حيث يمكننا توقع كيفية تفاعل العناصر مع بعضها البعض وتشكيل المركبات الجديدة.
- في الختام، يمثل النموذج الذري أداة قيمة في فهم عالم الذرات وتركيبها.
- عند دراسة الكيمياء، يجب علينا فهم كيفية عمل هذا النموذج وتطبيقه في التفاعلات الكيميائية.
- بناء على ذلك، يمكننا أن نقول بأن النموذج الذري يلعب دورًا حاسمًا في تطور علم الكيمياء وتقدمه.